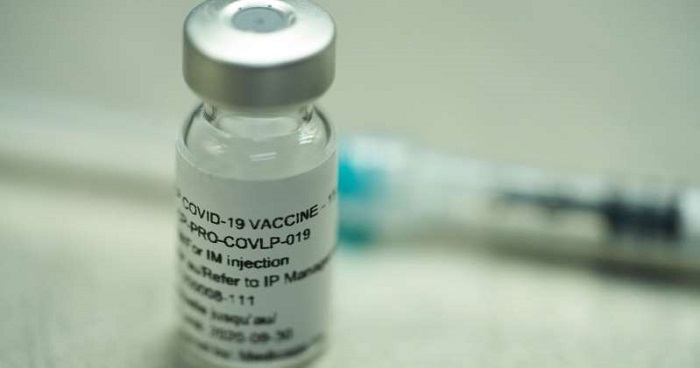
La candidata a vacuna de ARN desarrollada
por Pfizer y BioNTech ha demostrado inducir una robusta
respuesta inmunológica en un ensayo clínico preliminar realizado con 45
adultos sanos de 18 a 55 años y cuyos resultados se publican hoy en Nature.
La BNT162b1 es la más prometedora de las cuatro
vacunas desarrolladas por la farmacéutica estadounidense Pfizer y la empresa
alemana BioNTech, todas ellas basadas en el ARN mensajero para provocar una
respuesta inmunológica.
Este tipo de candidatas a vacunas son las que se consideran
generalmente seguras y han facilitado el rápido desarrollo de vacunas contra el
SARS-CoV-2.
Según los datos provisionales del estudio clínico en fase
1/2, realizado para evaluar la seguridad, tolerabilidad e inmunogenicidad de la
vacuna, la BNT162b1, que se administra por vía intramuscular, se testó en 45
adultos sanos (23 hombres y 22 mujeres no embarazadas; 37 participantes eran de
raza blanca) de 18 a 55 años de edad.
Los candidatos -asignados al azar- recibieron 10 microgramos
(μg), 30 μg o 100 μg de BNT162b1, o un placebo; además, los participantes de
los grupos 10μg y 30μg también recibieron una segunda dosis el día 21.
Los autores constataron que el BNT162b1 era, por lo general,
bien tolerado, aunque algunos participantes experimentaron, en los siete días
siguientes a la vacunación, efectos secundarios de leves a moderados, que
aumentaron con el nivel de la dosis.
Las reacciones adversas más frecuentes fueron dolor local en
el lugar de la inyección, fatiga, dolor de cabeza, dolor muscular, escalofríos,
fiebre y trastornos del sueño.
No obstante, la vacuna provocó una respuesta inmunológica
robusta en los participantes, que aumentó con el nivel de la dosis y con una
segunda dosis.
Los anticuerpos contra el SARS-CoV-2 permanecían 21 días
después de la primera vacunación en todos los niveles de dosis, y se registró
un aumento sustancial de los anticuerpos neutralizantes contra el SARS-CoV-2
siete días después de que se administrara la segunda dosis de 10-μg o 30-μg.
La respuesta inmunológica fue mucho más fuerte en el grupo
30-μg que en el grupo 10-μg.
Sin embargo, no hubo diferencias notables en la respuesta
inmunológica entre los grupos de 30-μg y 100-μg tras la primera dosis, y como
los participantes que recibieron la dosis de 100-μg también experimentaron
mayores efectos secundarios, no recibieron una segunda dosis.
Los niveles de anticuerpos neutralizantes de los
participantes fueron de 1.9 a 4.6 veces más altos que los de los pacientes que
se recuperaban de la infección por el SARS-CoV-2.
Sin embargo, aunque esta comparación proporciona un punto de
referencia para evaluar la respuesta inmunológica provocada por la vacuna y su
potencial para proporcionar protección, se necesitan ensayos de fase 3 para
determinar la eficacia de la BNT162b1.
Para ese estudio se están reclutando adultos de 65 a 85
años, y en fases posteriores se dará prioridad al reclutamiento de poblaciones
más diversas, apunta el estudio.
Fuente: EFE
Publicado por:Noticias de Última Hora
“We are proud to be among the first international biopharmaceutical companies to initiate a clinical trial of a #COVID19 #vaccine candidate in #China as part of our effort to make our vaccine available globally, if approved,” said our CEO Ugur Sahin. https://t.co/0Sfc1HTqTs pic.twitter.com/zmMhMvP92l
— BioNTech SE (@BioNTech_Group) August 5, 2020


Por sentarse mucho tiempo en el baño con su celular, se le salieron las 'tripas'
EL MUNDO


Los gritos desgarradores de la mamá de Susana al cantar "Libre soy"
MÉXICO
Aprobado: quitarán licencia de por vida a quien conduzca ebrio y mate a alguien
MÉRIDA
Hermano del "karateca golpeador" amenaza a familiares de la víctima, denuncian
MÉRIDA
Surge ‘La Furia Negra’, grupo armado para combatir narcos ¿y las autoridades?
MÉXICO
Reciclador de basura halla roca en la playa que lo hizo millonario
DIVERSIÓN